AMINAS, AMIDAS Y NITRILOS.
AMINAS:
¿QUÉ SON ?:
Se pueden considerar compuestos derivados del amoníaco (NH3) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se sustituyan se denominan aminas primarias, secundarias o terciarias.

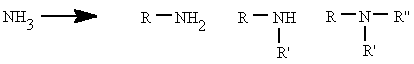

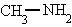
metilamina.
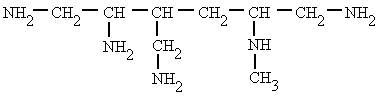
PROPIEDADES FISICAS:
Las aminas son compuestos incoloros que se oxidan con facilidad lo que permite que se encuentren como compuestos coloreados. Los primeros miembros de esta serie son gases con olor similar al amoníaco. A medida que aumenta el número de átomos de carbono en la molécula, el olor se hace similar al del pescado. Las aminas aromáticas son muy tóxicas se absorben a través de la piel.
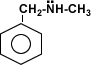 Amina secundaria aromática |
Amina terciaria aromática |
| Nombre | Pto. de fusión(ºC) | Pto. de ebullición(ºC) | Solubilidad (gr/100 gr de H2O) |
| Metil-amina | -92 | -7,5 | Muy soluble |
| Dimetil-amina | -96 | 7,5 | Muy soluble |
| Trimetil-amina | -117 | 3 | 91 |
| Fenil-amina | -6 | 184 | 3,7 |
| Difenil-amina | 53 | 302 | Insoluble |
| Metilfenil-amina | -57 | 196 | Muy poco soluble |
Las aminas se encuentran formando parte de la naturaleza, en los aminoácidos que conforman las proteínas que son un componente esencial del organismo de los seres vivos. Al degradarse las proteínas se descomponen en distintas aminas, como cadaverina y putrescina entre otras. Las cuales emiten olor desagradable. Es por ello que cuando la carne de aves, pescado y res no es preservada mediante refrigeración, los microorganismos que se encuentran en ella degradan las proteínas en aminas y se produce un olor desagradable.
 Las aminas son parte de los alcaloides que son compuestos complejos que se
encuentran en las plantas. Algunos de ellos son la morfina y la nicotina.
Algunas aminas son biológicamente importantes como la adrenalina y la
noradrenalina.
Las aminas son parte de los alcaloides que son compuestos complejos que se
encuentran en las plantas. Algunos de ellos son la morfina y la nicotina.
Algunas aminas son biológicamente importantes como la adrenalina y la
noradrenalina. Las aminas secundarias que se encuentran en las carnes y los pescados o en el humo del tabaco.
Estas aminas pueden reaccionar con los nitritos presentes en conservantes empleados en la alimentación y en plantas, procedentes del uso de fertilizantes, originando N-nitrosoaminas secundarias, que son carcinógenas.
Los tenso actínidos catiónicos son agentes de flotación que se utilizan para separar minerales valiosos de su ganga, porque se absorben sobre las partículas cristalinas ácidas. En otros casos el que flota es preferentemente el mineral valioso, dependiendo de su composición.
Los compuestos de tipo b) con dos cadenas largas en el N, son los componentes activos de los productos suavizantes o ablandadores de tejidos que se usan después de el lavado y enjuagado de toallas, sabanas y prendas de vestir al fijarse sobre las fibras por su parte ionica las lubrica e impide su adherencia al secarse.
Las aminas de tipo e) se utilizan para preparar emulsiones de asfalto que se adhieren muy bien al lecho de roca o piedras y al cemento.
Las etanolaminas se utilizan para preparan amidas que son detergentes no iónicos empleados en preparados cosméticos, por su carácter suavizante, y para la fabricación de morfolina, un disolvente industrial de amplio uso.


AMIDAS:

¿ QUE SON?
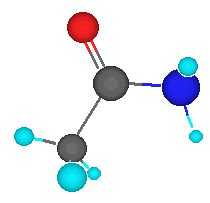
Las amidas son derivados de los ácidos carboxílicos. Todas las amidas
contienen un átomo de nitrógeno unido a un grupo carbonilo. La fórmula general
de una amida es:

Las amidas primarias se nombran sustituyendo la terminación oico o ico del nombre sistemático o vulgar, del ácido del que derivan, por el sufijo amida. En las amidas sustituidas se antepone al nombre anterior el de los radicales sobre el nitrógeno, precedidos de la letra N. Ejemplos:
 | ||
| metanamida (formamida) | N-metiletanamida (N-metilacetamida) | N,N-dietilbenzamida |
.
PROPIEDADES FÍSICAS:
El grupo funcional amida es bastante polar, lo que explica que las amidas primarias, excepto la formamida (p.f.=2,5 ºC), sean todas sólidas y solubles en agua. Sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes, debido a una gran asociación intermolecular a través de enlaces de hidrógeno, entre el oxígeno negativo y los enlaces N—H, mucho más polarizados que en las aminas. Los puntos de fusión y de ebullición de las amidas secundarias son bastante menores, debido principalmente al impedimento estérico del radical unido al nitrógeno para la asociación. Como es natural, las amidas terciarias (sin enlaces N—H) no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y de ebullición de acuerdo con su peso molecular.
Propiedades Químicas
Basicidad
Las amidas son básicas, debido a la interacción mesómera entre el doble enlace carbonílo y el par de electrones del átomo de nitrógeno
La carga positiva parcial que resulta sobre el átomo de nitrógeno disminuye su
basicidad y la protonación de las amidas que solo tiene lugar, en
condiciones fuertemente ácidas, ocurre sobre el átomo de oxígeno, ya que así la carga del
catión resultante queda deslocalizada, lo que ocurriría si el catión se formase por
protonación del nitrógeno
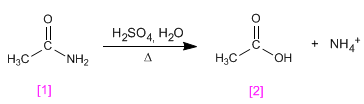
 Hidrólisis Ácida
Hidrólisis Ácida
La hidrólisis ácida de las amidas primarias produce ácido orgánico libre y una sal de
amonio. Las amidas secundarias y terciarias producen el correspondiente ácido y una sal de
amonio cuaternario.
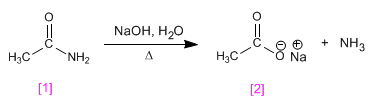
Básica
La hidrólisis básica de las amidas produce una sal de ácido orgánico y amoníaco o aminas, según el tipo de amida.
Las amidas son básicas, debido a la interacción mesómera entre el doble enlace carbonílo y el par de electrones del átomo de nitrógeno
La carga positiva parcial que resulta sobre el átomo de nitrógeno disminuye su
basicidad y la protonación de las amidas que solo tiene lugar, en
condiciones fuertemente ácidas, ocurre sobre el átomo de oxígeno, ya que así la carga del
catión resultante queda deslocalizada, lo que ocurriría si el catión se formase por
protonación del nitrógeno
La hidrólisis ácida de las amidas primarias produce ácido orgánico libre y una sal de
amonio. Las amidas secundarias y terciarias producen el correspondiente ácido y una sal de
amonio cuaternario.

La hidrólisis básica de las amidas produce una sal de ácido orgánico y amoníaco o aminas, según el tipo de amida.

Reacción de las
amidas con el ácido nitroso
Al tratar amidas con
ácido nitroso, se convierte en ácido orgánico, desprendiéndose el nitrógeno
gaseoso.
Reacción de
hoffman
Se trata una solución
acuosa de amida con hipoclorito o hipodromito de sodio e hidroxido de sodio ,
formando así una amina pura. Esta reacción es característica de las amidas
primarias.
Reducción de
amidas
Para convertir una
amida en amina se usa el hidruro de litio y el aluminio.
IMPORTANCIA INDUSTRIAL Y BIOTECNOLOGICA
Las amidas no sustituidas de los ácidos carboxílicos alifáticos se utilizan ampliamente como productos intermedios, estabilizantes,
agentes de desmolde para plásticos, películas,surfactantes y fundentes. Las amidas sustituidas, como la dimetilformamida y la
dimetilacetamida tienen propiedades disolventes muy poderosas.La dimetilformamida se utiliza principalmente como disolvente en
procesos de síntesis orgánica y en la preparación de fibras sintéticas.

También constituye un medio selectivo para la extracción de compuestos aromáticos a partir del petróleo crudo y un disolvente para colorantes. Tanto la dimetilformamida como la imetilacetamida son componentes de disolventes de pinturas.

La dimetilacetamida se emplea también como disolvente de plásticos,
resinas y gomas y en numerosas reacciones orgánicas.
La acetamida se utiliza para la desnaturalización del alcohol y como disolvente de numerosos compuestos orgánicos, como plastificante y como aditivo para el papel. También se encuentra en lacas, explosivos y fundentes.


La formamida es un ablandador de papel y pegamentos y se utiliza como disolvente en la industria de plásticos y farmacéutica. Algunas amidas alifáticas no saturadas, como la acrilamida, son monómeros reactivos que se utilizan en la síntesis de polímeros.La acrilamida se utiliza también en la síntesis de colorantes,adhesivos, en el engomado del papel y el apresto de textiles, en
tejidos plisados y en el tratamiento del agua y las aguas residuales.


En la industria del metal se utiliza para el procesado de minerales y en ingeniería civil, para la construcción de cimientos de presas y túneles. Las poliacrilamidas se utilizan ampliamente como agentes floculantes en el tratamiento del agua y las aguas residuales y como agentes reforzadores en los procesos de fabricación
de papel en la industria papelera. Los compuestos de amidas aromáticas son importantes productos intermedios en la industria de los colorantes y en medicina. Algunos también son repelentes de insectos.

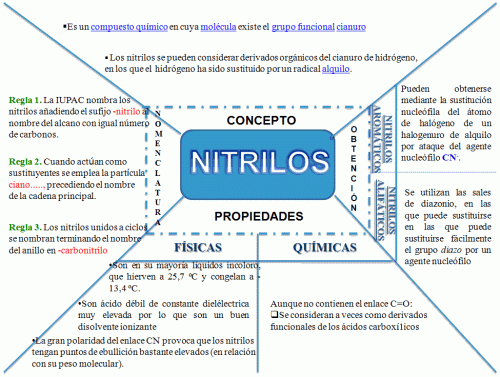
NITRILOS:
¿Qué Son?
Se caracterizan por
tener el grupo funcional "ciano" -CN, por lo que a veces también se les
denomina cianuros de alquilo.
¿Cómo se
nombran?
Hay varios sistemas válidos de nomenclatura para estos compuestos. En
los casos sencillos las posibilidades son tres:
A)
añadir el sufijo -nitrilo al nombre del hidrocarburo de
igual número de átomos de carbono;
etanonitrilo
B)
considerarlo como un derivado del ácido cianhídrico, HCN.
cianuro de propilo
C)
nombrarlo como derivado del ácido RCOOH, relacionando RCOOH con RCN, en el caso
de que dicho ácido tenga nombre trivial aceptado.
acetonitrilo
EJEMPLOS:
etanonitrilo
cianuro de metiloacetonitrilo | |
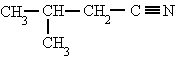 |
3-metilbutanonitrilo |
 |
cianuro de
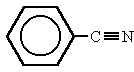
fenilobenzonitrilo
|
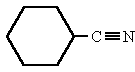 |
ciclohexanocarbonitrilo |
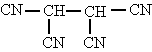 |
1,1,2,2-etanotetracarbonitrilo |
| 2-butenonitrilo |
Propiedades físicas:
El enlace triple CN difiere bastante del C—C, siendo algo más fuerte y mucho más polarizado, en el sentido +CN-, lo mismo que ocurría en el enlace C=O. La gran polaridad del enlace CN provoca que los nitrilos tengan puntos de ebullición bastante elevados (en relación con su peso molecular). Asimismo, son buenos disolventes de compuestos orgánicos polares, como ácidos carboxílicos, aldehídos y cetonas, etc., siendo a su vez relativamente solubles en agua.
IMPORTANCIA INDUSTRIAL Y BIOTECNOLOGICA:
1) Impermeable y flexible con recubrimiento interno para un mayor confort, absorbe la transpiración y facilita la colocación. Texturado en palma y los dedos para un buen agarre.

2) Con una formulación específica para una alta resistencia a la mayoría de los solventes y bases oleosas.

3) Para aplicaciones industriales como procesamiento de productos alimenticios (carnes rojas, lechería, etc.); procesamiento de productos químicos; reparación de maquinaria, artes gráficas y fabricación de baterías.

4) Excelente para elaborar todo tipo de empaques o bridas que contacten aceites, grasas o productos químicos diversos medianamente corrosivos.


LINK DE IMAGENES:
8.http://www.google.com.co/imgres?num=10&hl=es&sa=X&biw=1511&bih=741&tbm=isch&tbnid=NjyirntplrV4TM:&imgrefurl=http://rvsamuelacosta.wordpress.com/2010/12/24/la-ley-del-vaso-con-agua/&docid=c29pSS_LX7NrXM&imgurl=http://rvsamuelacosta.files.wordpress.com/2010/12/vaso_de_agua.jpg&w=303&h=320&ei=9LuOUKjLIMTz0gHLv4HwDw&zoom=1&iact=hc&vpx=473&vpy=181&dur=688&hovh=184&hovw=176&tx=95&ty=109&sig=117667461311469930716&page=1&tbnh=146&tbnw=143&start=0&ndsp=33&ved=1t:429,r:2,s:0,i:135
9.http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=xdlOMIQgRtRIHM:&imgrefurl=http://www.deciencias.net/simulaciones/quimica/carbono/nitrogenados.htm&docid=1M1RxEkTPmbzfM&imgurl=http://www.deciencias.net/simulaciones/quimica/carbono/comp/amida.gif&w=210&h=203&ei=pryOUNOJBaGR0gGXtoCoCg&zoom=1&iact=hc&vpx=412&vpy=364&dur=434&hovh=162&hovw=167&tx=60&ty=68&sig=117667461311469930716&page=1&tbnh=156&tbnw=164&start=0&ndsp=16&ved=1t:429,r:7,s:0,i:98.
10. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=Z8QV-locQPFp0M:&imgrefurl=http://pa1bachacarort.wordpress.com/&docid=0OTJkU9u7-C4-M&imgurl=http://pa1bachacarort.files.wordpress.com/2008/11/image541.gif&w=340&h=258&ei=pryOUNOJBaGR0gGXtoCoCg&zoom=1&iact=hc&vpx=177&vpy=270&dur=279&hovh=137&hovw=155&tx=147&ty=88&sig=117667461311469930716&page=2&tbnh=138&tbnw=155&start=16&ndsp=27&ved=1t:429,r:12,s:20,i:176
11. http://www.google.com.co/imgres?num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=2A0eksO8JYUhpM:&imgrefurl=http://www.alergias.net/tipos/ropa/fibras-sinteticas/&docid=-3kat0wizy5jwM&imgurl=http://www.alergias.net/wp-content/uploads/2012/03/alergia-a-las-fibras-sinteticas.jpg&w=421&h=408&ei=U72OUM_9E5PC9gTMo4DgCg&zoom=1&iact=rc&dur=299&sig=117667461311469930716&sqi=2&page=1&tbnh=154&tbnw=162&start=0&ndsp=18&ved=1t:429,r:5,s:0,i:92&tx=67&ty=50
12. http://www.google.com.co/imgres?start=20&num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=9B2icLL4nah4PM:&imgrefurl=http://sanidadagroalimentaria.com/detalle_id1.php%3Fn%3Dpinturas-tixotropicas%26id%3D40%26id_catalogo%3D1%26fam%3D33&docid=Cj2aZw4R2KBH6M&imgurl=http://sanidadagroalimentaria.com/userimg/products/pots%252520pintura%2525202.jpg&w=300&h=300&ei=v72OUJzzJuy40QGeqYCwCQ&zoom=1&iact=hc&vpx=517&vpy=380&dur=380&hovh=220&hovw=218&tx=89&ty=97&sig=117667461311469930716&page=2&tbnh=150&tbnw=145&ndsp=31&ved=1t:429,r:8,s:20,i:28
13.http://www.google.com.co/imgres?num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=BJlNdbhXXgyutM:&imgrefurl=http://alocubano.wordpress.com/2011/09/26/envases-plasticos-un-dano-duradero-para-el-medioambiente/&docid=waBOHyarqPkA7M&imgurl=http://alocubano.files.wordpress.com/2011/09/envases-plasticos-pet.jpg&w=352&h=259&ei=CL6OULrsHZLy8AScy4G4BQ&zoom=1&iact=rc&dur=440&sig=117667461311469930716&sqi=2&page=1&tbnh=128&tbnw=171&start=0&ndsp=25&ved=1t:429,r:4,s:0,i:141&tx=111&ty=78
14. http://www.google.com.co/imgres?num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=4RJmWbJdpRiRDM:&imgrefurl=http://es.wikipedia.org/wiki/Pl%25C3%25A1stico&docid=5YH0SilzZolfMM&imgurl=http://upload.wikimedia.org/wikipedia/commons/thumb/b/b2/Plastic_household_items.jpg/250px-Plastic_household_items.jpg&w=250&h=166&ei=CL6OULrsHZLy8AScy4G4BQ&zoom=1&iact=rc&dur=159&sig=117667461311469930716&sqi=2&page=1&tbnh=128&tbnw=191&start=0&ndsp=25&ved=1t:429,r:0,s:0,i:129&tx=65&ty=10
15. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=5E_SehfIw2HjnM:&imgrefurl=http://www.trendenciasbelleza.com/consejos-de-belleza/si-estas-embarazada-ojo-con-las-lacas&docid=hbNNxpWFPk9ivM&imgurl=http://img.trendenciasbelleza.com/2008/12/laca.jpg&w=386&h=400&ei=3r6OUJryN-uH0QHRyIDgDw&zoom=1&iact=rc&dur=427&sig=117667461311469930716&page=1&tbnh=131&tbnw=132&start=0&ndsp=29&ved=1t:429,r:3,s:0,i:86&tx=70&ty=61
16.http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=FvaG-Vtd2pUQxM:&imgrefurl=http://www.novaciencia.com/2007/01/31/deteccion-de-explosivos-con-ondas-de-radio/&docid=anxqat4Mr4dwnM&imgurl=http://www.novaciencia.com/wp-content/Dinamita.jpg&w=200&h=150&ei=M7-OUN_TGvS_0QG9s4CABg&zoom=1&iact=rc&dur=366&sig=117667461311469930716&page=1&tbnh=120&tbnw=158&start=0&ndsp=18&ved=1t:429,r:3,s:0,i:138&tx=86&ty=81
17. http://www.google.com.co/imgres?hl=es&sa=X&biw=1377&bih=707&tbm=isch&tbnid=RKppW0rEFpBwpM:&imgrefurl=http://www.ati-intl.com/salumsld.htm&docid=s9AUKPs6HfhAOM&imgurl=http://www.ati-intl.com/alflxsld.gif&w=189&h=216&ei=RMCOUImEMuf40gHj7oCQCQ&zoom=1&iact=rc&dur=304&sig=117667461311469930716&page=1&tbnh=135&tbnw=130&start=0&ndsp=27&ved=1t:429,r:2,s:0,i:69&tx=39&ty=56
18. http://www.google.com.co/imgres?num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=eX7jebtZyVrpBM:&imgrefurl=http://radio.rpp.com.pe/cuidaelagua/sni-el-agua-residual-debe-tener-valor-comercial/&docid=yzOLUlFMBiIWDM&imgurl=http://radio.rpp.com.pe/cuidaelagua/files/2010/12/aguas-residuales.jpg&w=545&h=362&ei=gMCOUKypO46m8gS0_oGwBQ&zoom=1&iact=rc&dur=332&sig=117667461311469930716&sqi=2&page=1&tbnh=144&tbnw=243&start=0&ndsp=15&ved=1t:429,r:5,s:0,i:144&tx=75&ty=54
19. http://salutip.blogspot.com/2012/06/como-se-fabrica-el-papel.html
20. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=5cGQVq-ucUWqfM:&imgrefurl=http://www.deciencias.net/simulaciones/quimica/carbono/nitrogenados.htm&docid=1M1RxEkTPmbzfM&imgurl=http://www.deciencias.net/simulaciones/quimica/carbono/comp/nitrilo.gif&w=225&h=167&ei=dcKOUODQFuip0AHk_YHgCQ&zoom=1&iact=rc&dur=342&sig=117667461311469930716&page=1&tbnh=132&tbnw=180&start=0&ndsp=23&ved=1t:429,r:1,s:0,i:66&tx=92&ty=61
21. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=X5GD2aSJyLCxcM:&imgrefurl=http://www.ecured.cu/index.php/Nitrilo&docid=NjlfKIi4JrLGGM&imgurl=http://www.ecured.cu/images/6/6d/Eddddteno.jpg&w=253&h=207&ei=dcKOUODQFuip0AHk_YHgCQ&zoom=1&iact=rc&dur=383&sig=117667461311469930716&page=1&tbnh=161&tbnw=202&start=0&ndsp=23&ved=1t:429,r:2,s:0,i:69&tx=164&ty=101
22. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=RZovXyomD4dOZM:&imgrefurl=http://losapuntesdeclase.blogspot.com/2008/09/nitrilos-ni-marxistas.html&docid=kPA8qdwkTMc9uM&imgurl=https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjxmq9TouzAMVCK0-BiIFD8GEy6Tssmythf0tO_G6UutYSkiFDumQWdGVbYcHjPXcHXlS0PT97-W9GEuJFS1zGPwL73BIXENanRl_GqHocfAHE5TH9Lf7Ci6NvqMioNtBx3kOlnV3Tr19zV/s320/butanonitrilo.gif&w=211&h=149&ei=dcKOUODQFuip0AHk_YHgCQ&zoom=1&iact=rc&dur=287&sig=117667461311469930716&page=1&tbnh=118&tbnw=167&start=0&ndsp=23&ved=1t:429,r:0,s:0,i:63&tx=99&ty=40
23. http://www.google.com.co/imgres?um=1&hl=es&sa=N&biw=1360&bih=667&tbm=isch&tbnid=fDF2lShXdjlVyM:&imgrefurl=http://www.opcionescomerciales.com/productos.aspx%3Fcat%3D1&docid=R1uH7g9B1tcYIM&imgurl=http://www.opcionescomerciales.com/Imagenes/Productos/nitrilos_desechables_img.jpg&w=516&h=527&ei=MOmPUIOQHoma9QTNpoDgAQ&zoom=1&iact=hc&vpx=948&vpy=4&dur=29&hovh=227&hovw=222&tx=114&ty=61&sig=101534516403232750673&page=2&tbnh=90&tbnw=80&start=16&ndsp=29&ved=1t:429,i:133
24. http://www.google.com.co/imgres?um=1&hl=es&sa=X&biw=1360&bih=667&tbm=isch&tbnid=gvhG9VVejRkdSM:&imgrefurl=http://valencia.olx.com.ve/solventes-quimicos-agentes-quimicos-formulas-compuestos-quimicos-productos-quimicos-iid-235225554&docid=3pHcMmk4892ZRM&imgurl=http://images01.olx.com.ve/ui/11/59/54/1312321063_235225554_1-SOLVENTES-QUIMICOSAGENTES-QUIMICOSFORMULASCOMPUESTOS-QUIMICOSPRODUCTOS-QUIMICOS-AV-BOLIVAR-NORTE.jpg&w=275&h=183&ei=aOmPUImPD4v69gTE0IGIAg&zoom=1&iact=rc&dur=531&sig=101534516403232750673&page=1&tbnh=146&tbnw=220&start=0&ndsp=18&ved=1t:429,i:63&tx=105&ty=45
25. http://www.google.com.co/imgres?um=1&hl=es&biw=1360&bih=667&tbm=isch&tbnid=izwr0kvoFar_rM:&imgrefurl=http://www.inspira.es/lo-que-hay-que-saber-para-comprar-carne-online&docid=bBxjkhvpSCpdTM&imgurl=http://sobreconceptos.com/wp-content/uploads/carnes.jpg&w=500&h=354&ei=2OmPUNTaEYSs8QTzxYCQBA&zoom=1&iact=rc&dur=413&sig=101534516403232750673&page=1&tbnh=136&tbnw=205&start=0&ndsp=19&ved=1t:429,i:141&tx=95&ty=37
26. http://www.google.com.co/imgres?um=1&hl=es&biw=1360&bih=667&tbm=isch&tbnid=zh7L8ZSWa7T7zM:&imgrefurl=http://laresina.wordpress.com/2009/03/17/empaque-para-cafes/&docid=QeVabLfxEDS9TM&imgurl=http://laresina.files.wordpress.com/2009/03/empaques-pcafe.jpg&w=1014&h=764&ei=8-mPUM32MYrc9ASEloCoCQ&zoom=1&iact=rc&dur=342&sig=101534516403232750673&page=1&tbnh=135&tbnw=163&start=0&ndsp=20&ved=1t:429,i:138&tx=76&ty=30
27. http://www.google.com.co/imgres?um=1&hl=es&biw=1360&bih=667&tbm=isch&tbnid=FBWUHJR9v-SqkM:&imgrefurl=http://www.echateunclick.com/blog/2009/06/21/empaques-y-embalajes/&docid=MgitPfS8tDjesM&imgurl=http://www.echateunclick.com/blog/wp-content/uploads/2009/06/empaqueskl6-300x212.jpg&w=300&h=212&ei=8-mPUM32MYrc9ASEloCoCQ&zoom=1&iact=rc&dur=531&sig=101534516403232750673&page=1&tbnh=132&tbnw=181&start=0&ndsp=18&ved=1t:429,i:144&tx=145&ty=61
9.http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=xdlOMIQgRtRIHM:&imgrefurl=http://www.deciencias.net/simulaciones/quimica/carbono/nitrogenados.htm&docid=1M1RxEkTPmbzfM&imgurl=http://www.deciencias.net/simulaciones/quimica/carbono/comp/amida.gif&w=210&h=203&ei=pryOUNOJBaGR0gGXtoCoCg&zoom=1&iact=hc&vpx=412&vpy=364&dur=434&hovh=162&hovw=167&tx=60&ty=68&sig=117667461311469930716&page=1&tbnh=156&tbnw=164&start=0&ndsp=16&ved=1t:429,r:7,s:0,i:98.
10. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=Z8QV-locQPFp0M:&imgrefurl=http://pa1bachacarort.wordpress.com/&docid=0OTJkU9u7-C4-M&imgurl=http://pa1bachacarort.files.wordpress.com/2008/11/image541.gif&w=340&h=258&ei=pryOUNOJBaGR0gGXtoCoCg&zoom=1&iact=hc&vpx=177&vpy=270&dur=279&hovh=137&hovw=155&tx=147&ty=88&sig=117667461311469930716&page=2&tbnh=138&tbnw=155&start=16&ndsp=27&ved=1t:429,r:12,s:20,i:176
11. http://www.google.com.co/imgres?num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=2A0eksO8JYUhpM:&imgrefurl=http://www.alergias.net/tipos/ropa/fibras-sinteticas/&docid=-3kat0wizy5jwM&imgurl=http://www.alergias.net/wp-content/uploads/2012/03/alergia-a-las-fibras-sinteticas.jpg&w=421&h=408&ei=U72OUM_9E5PC9gTMo4DgCg&zoom=1&iact=rc&dur=299&sig=117667461311469930716&sqi=2&page=1&tbnh=154&tbnw=162&start=0&ndsp=18&ved=1t:429,r:5,s:0,i:92&tx=67&ty=50
12. http://www.google.com.co/imgres?start=20&num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=9B2icLL4nah4PM:&imgrefurl=http://sanidadagroalimentaria.com/detalle_id1.php%3Fn%3Dpinturas-tixotropicas%26id%3D40%26id_catalogo%3D1%26fam%3D33&docid=Cj2aZw4R2KBH6M&imgurl=http://sanidadagroalimentaria.com/userimg/products/pots%252520pintura%2525202.jpg&w=300&h=300&ei=v72OUJzzJuy40QGeqYCwCQ&zoom=1&iact=hc&vpx=517&vpy=380&dur=380&hovh=220&hovw=218&tx=89&ty=97&sig=117667461311469930716&page=2&tbnh=150&tbnw=145&ndsp=31&ved=1t:429,r:8,s:20,i:28
13.http://www.google.com.co/imgres?num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=BJlNdbhXXgyutM:&imgrefurl=http://alocubano.wordpress.com/2011/09/26/envases-plasticos-un-dano-duradero-para-el-medioambiente/&docid=waBOHyarqPkA7M&imgurl=http://alocubano.files.wordpress.com/2011/09/envases-plasticos-pet.jpg&w=352&h=259&ei=CL6OULrsHZLy8AScy4G4BQ&zoom=1&iact=rc&dur=440&sig=117667461311469930716&sqi=2&page=1&tbnh=128&tbnw=171&start=0&ndsp=25&ved=1t:429,r:4,s:0,i:141&tx=111&ty=78
14. http://www.google.com.co/imgres?num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=4RJmWbJdpRiRDM:&imgrefurl=http://es.wikipedia.org/wiki/Pl%25C3%25A1stico&docid=5YH0SilzZolfMM&imgurl=http://upload.wikimedia.org/wikipedia/commons/thumb/b/b2/Plastic_household_items.jpg/250px-Plastic_household_items.jpg&w=250&h=166&ei=CL6OULrsHZLy8AScy4G4BQ&zoom=1&iact=rc&dur=159&sig=117667461311469930716&sqi=2&page=1&tbnh=128&tbnw=191&start=0&ndsp=25&ved=1t:429,r:0,s:0,i:129&tx=65&ty=10
15. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=5E_SehfIw2HjnM:&imgrefurl=http://www.trendenciasbelleza.com/consejos-de-belleza/si-estas-embarazada-ojo-con-las-lacas&docid=hbNNxpWFPk9ivM&imgurl=http://img.trendenciasbelleza.com/2008/12/laca.jpg&w=386&h=400&ei=3r6OUJryN-uH0QHRyIDgDw&zoom=1&iact=rc&dur=427&sig=117667461311469930716&page=1&tbnh=131&tbnw=132&start=0&ndsp=29&ved=1t:429,r:3,s:0,i:86&tx=70&ty=61
16.http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=FvaG-Vtd2pUQxM:&imgrefurl=http://www.novaciencia.com/2007/01/31/deteccion-de-explosivos-con-ondas-de-radio/&docid=anxqat4Mr4dwnM&imgurl=http://www.novaciencia.com/wp-content/Dinamita.jpg&w=200&h=150&ei=M7-OUN_TGvS_0QG9s4CABg&zoom=1&iact=rc&dur=366&sig=117667461311469930716&page=1&tbnh=120&tbnw=158&start=0&ndsp=18&ved=1t:429,r:3,s:0,i:138&tx=86&ty=81
17. http://www.google.com.co/imgres?hl=es&sa=X&biw=1377&bih=707&tbm=isch&tbnid=RKppW0rEFpBwpM:&imgrefurl=http://www.ati-intl.com/salumsld.htm&docid=s9AUKPs6HfhAOM&imgurl=http://www.ati-intl.com/alflxsld.gif&w=189&h=216&ei=RMCOUImEMuf40gHj7oCQCQ&zoom=1&iact=rc&dur=304&sig=117667461311469930716&page=1&tbnh=135&tbnw=130&start=0&ndsp=27&ved=1t:429,r:2,s:0,i:69&tx=39&ty=56
18. http://www.google.com.co/imgres?num=10&hl=es&biw=1377&bih=707&tbm=isch&tbnid=eX7jebtZyVrpBM:&imgrefurl=http://radio.rpp.com.pe/cuidaelagua/sni-el-agua-residual-debe-tener-valor-comercial/&docid=yzOLUlFMBiIWDM&imgurl=http://radio.rpp.com.pe/cuidaelagua/files/2010/12/aguas-residuales.jpg&w=545&h=362&ei=gMCOUKypO46m8gS0_oGwBQ&zoom=1&iact=rc&dur=332&sig=117667461311469930716&sqi=2&page=1&tbnh=144&tbnw=243&start=0&ndsp=15&ved=1t:429,r:5,s:0,i:144&tx=75&ty=54
19. http://salutip.blogspot.com/2012/06/como-se-fabrica-el-papel.html
20. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=5cGQVq-ucUWqfM:&imgrefurl=http://www.deciencias.net/simulaciones/quimica/carbono/nitrogenados.htm&docid=1M1RxEkTPmbzfM&imgurl=http://www.deciencias.net/simulaciones/quimica/carbono/comp/nitrilo.gif&w=225&h=167&ei=dcKOUODQFuip0AHk_YHgCQ&zoom=1&iact=rc&dur=342&sig=117667461311469930716&page=1&tbnh=132&tbnw=180&start=0&ndsp=23&ved=1t:429,r:1,s:0,i:66&tx=92&ty=61
21. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=X5GD2aSJyLCxcM:&imgrefurl=http://www.ecured.cu/index.php/Nitrilo&docid=NjlfKIi4JrLGGM&imgurl=http://www.ecured.cu/images/6/6d/Eddddteno.jpg&w=253&h=207&ei=dcKOUODQFuip0AHk_YHgCQ&zoom=1&iact=rc&dur=383&sig=117667461311469930716&page=1&tbnh=161&tbnw=202&start=0&ndsp=23&ved=1t:429,r:2,s:0,i:69&tx=164&ty=101
22. http://www.google.com.co/imgres?hl=es&biw=1377&bih=707&tbm=isch&tbnid=RZovXyomD4dOZM:&imgrefurl=http://losapuntesdeclase.blogspot.com/2008/09/nitrilos-ni-marxistas.html&docid=kPA8qdwkTMc9uM&imgurl=https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjxmq9TouzAMVCK0-BiIFD8GEy6Tssmythf0tO_G6UutYSkiFDumQWdGVbYcHjPXcHXlS0PT97-W9GEuJFS1zGPwL73BIXENanRl_GqHocfAHE5TH9Lf7Ci6NvqMioNtBx3kOlnV3Tr19zV/s320/butanonitrilo.gif&w=211&h=149&ei=dcKOUODQFuip0AHk_YHgCQ&zoom=1&iact=rc&dur=287&sig=117667461311469930716&page=1&tbnh=118&tbnw=167&start=0&ndsp=23&ved=1t:429,r:0,s:0,i:63&tx=99&ty=40
23. http://www.google.com.co/imgres?um=1&hl=es&sa=N&biw=1360&bih=667&tbm=isch&tbnid=fDF2lShXdjlVyM:&imgrefurl=http://www.opcionescomerciales.com/productos.aspx%3Fcat%3D1&docid=R1uH7g9B1tcYIM&imgurl=http://www.opcionescomerciales.com/Imagenes/Productos/nitrilos_desechables_img.jpg&w=516&h=527&ei=MOmPUIOQHoma9QTNpoDgAQ&zoom=1&iact=hc&vpx=948&vpy=4&dur=29&hovh=227&hovw=222&tx=114&ty=61&sig=101534516403232750673&page=2&tbnh=90&tbnw=80&start=16&ndsp=29&ved=1t:429,i:133
24. http://www.google.com.co/imgres?um=1&hl=es&sa=X&biw=1360&bih=667&tbm=isch&tbnid=gvhG9VVejRkdSM:&imgrefurl=http://valencia.olx.com.ve/solventes-quimicos-agentes-quimicos-formulas-compuestos-quimicos-productos-quimicos-iid-235225554&docid=3pHcMmk4892ZRM&imgurl=http://images01.olx.com.ve/ui/11/59/54/1312321063_235225554_1-SOLVENTES-QUIMICOSAGENTES-QUIMICOSFORMULASCOMPUESTOS-QUIMICOSPRODUCTOS-QUIMICOS-AV-BOLIVAR-NORTE.jpg&w=275&h=183&ei=aOmPUImPD4v69gTE0IGIAg&zoom=1&iact=rc&dur=531&sig=101534516403232750673&page=1&tbnh=146&tbnw=220&start=0&ndsp=18&ved=1t:429,i:63&tx=105&ty=45
25. http://www.google.com.co/imgres?um=1&hl=es&biw=1360&bih=667&tbm=isch&tbnid=izwr0kvoFar_rM:&imgrefurl=http://www.inspira.es/lo-que-hay-que-saber-para-comprar-carne-online&docid=bBxjkhvpSCpdTM&imgurl=http://sobreconceptos.com/wp-content/uploads/carnes.jpg&w=500&h=354&ei=2OmPUNTaEYSs8QTzxYCQBA&zoom=1&iact=rc&dur=413&sig=101534516403232750673&page=1&tbnh=136&tbnw=205&start=0&ndsp=19&ved=1t:429,i:141&tx=95&ty=37
26. http://www.google.com.co/imgres?um=1&hl=es&biw=1360&bih=667&tbm=isch&tbnid=zh7L8ZSWa7T7zM:&imgrefurl=http://laresina.wordpress.com/2009/03/17/empaque-para-cafes/&docid=QeVabLfxEDS9TM&imgurl=http://laresina.files.wordpress.com/2009/03/empaques-pcafe.jpg&w=1014&h=764&ei=8-mPUM32MYrc9ASEloCoCQ&zoom=1&iact=rc&dur=342&sig=101534516403232750673&page=1&tbnh=135&tbnw=163&start=0&ndsp=20&ved=1t:429,i:138&tx=76&ty=30
27. http://www.google.com.co/imgres?um=1&hl=es&biw=1360&bih=667&tbm=isch&tbnid=FBWUHJR9v-SqkM:&imgrefurl=http://www.echateunclick.com/blog/2009/06/21/empaques-y-embalajes/&docid=MgitPfS8tDjesM&imgurl=http://www.echateunclick.com/blog/wp-content/uploads/2009/06/empaqueskl6-300x212.jpg&w=300&h=212&ei=8-mPUM32MYrc9ASEloCoCQ&zoom=1&iact=rc&dur=531&sig=101534516403232750673&page=1&tbnh=132&tbnw=181&start=0&ndsp=18&ved=1t:429,i:144&tx=145&ty=61
1. QUIMICA ORGANICA; EDITORIAL:Santillana; AUTOR: Cesar Mondragon, Luz Yadira Peña, Martha Sánchez; UNIDAD: 5 Acidos Carboxilicos y funciones nitrogenadas; PÁGINAS: 136 - 142.
2. SPIN QUÍMICA 11; EDITORIAL: Voluntad S.A;AUTOR: Myriam Stella Fernandez Rincón, Jorge Omar Montero; PAGINAS: 135- 142.
3. HOLA QUIMICA TOMO 2, EDITORIAL: Indicadores de logro Sosaeta; AUTOR: Fabio Restrepo, Carmenza Barrera Quirogas; PAGINAS: 198-203.
4. QUIMICA SEGUNDA EDICIÒN; EDITORIAL: Pearson Educación; AUTOR: Paul Belfandi ;PAGINAS 626-630





No hay comentarios:
Publicar un comentario