 Mezcla: Está formada por la unión de sustancias en cantidades variables y que no se encuentran químicamente unidas. .
Mezcla: Está formada por la unión de sustancias en cantidades variables y que no se encuentran químicamente unidas. .Las mezclas están compuestas por una sustancia, que es el medio, en el que se encuentran una o más sustancias en menor proporción. Se llama FASE DISPERSANTE AL MEDIO Y FASE A LAS SUSTANCIAS QUE ESTÁN EN ÉL.
Ejemplo: Agua con azúcar
Agua → el medio → fase dispersante
Azúcar → fase dispersa
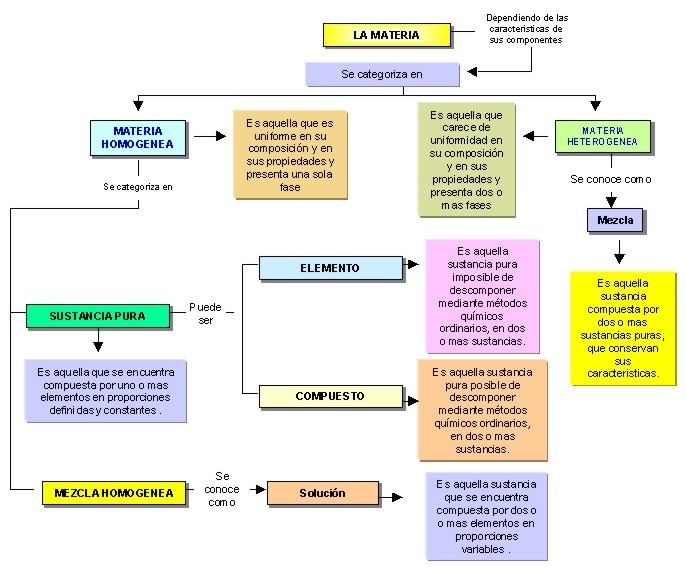
De acuerdo al tamaño, las mezclas pueden ser homogéneas o heterogéneas.
a) Mezclas homogéneas: Son aquellas cuyos componentes no son identificables a simple vista, es decir, se aprecia una sola fase física.
Ejemplo: El agua potable es una mezcla homogénea de agua (fase dispersante) y varias sales minerales (fase dispersa).MISCIBLE: Se refiere a la propiedad de unos liquidos para mezclarse en cualquier proporción, formando una solución homogénea.
Es aquella en donde no se separa las fases o las sustancias presentes como :
- Alcohol en agua.
- Benceno en tolueno.
- Ácido acetico en agua.
- Acetato de etilo en acido acetico.
b) Mezclas heterogéneas: Son aquellas cuyos componentes se pueden distinguir a simple vista, apreciándose más de una fase física.
Ejemplo: Agua con piedra, agua con aceite.
Las mezclas heterogéneas se pueden agrupar en:
Emulsiones: Conformada por 2 fases líquidas inmiscibles. Ejemplo: agua y aceite, leche, mayonesa.
Suspensiones: Conformada por una fase sólida insoluble en la fase dispersante líquida, por lo cual tiene un aspecto opaco. Las partículas dispersas son relativamente grandes. Ejemplo: Arcilla, tinta china (negro de humo y agua), pinturas al agua, cemento.
Coloides o soles: Es un sistema heterogéneo en donde el sistema disperso puede ser observado a través de un ultramicroscopio.
SOLUCIÓN / DISOLUCIÓN: Es una mezcla homogénea formada por dos o mas sustancias puras y cuya composición puede variar por lo general dentro de ciertos limites.
Las soluciones pueden estar formadas por sustancias de cualquier fase o estado (solido,liquido o gaseoso). las soluciones mas comunes son las que presentan fase liquida y en ellas el solvente es un liquido y el soluto puede tener cualquier fase antes de formar la solución de manera que pueda haber soluciones SOLIDO-LIQUIDO, LIQUIDO-LIQUIDO y GAS-LIQUIDO.
Algunos sólidos finamente divididos y mezclados podrían considerarse soluciones. las soluciones formadas por gases se nombran como mezclas heterogéneas pero son soluciones verdaderas.
Las soluciones mas comunes son aquellas en las cuales el solvente es un liquido (soluciones liquidas).
Las soluciones se clasifican según su :
- La cantidad de soluto: Pueden ser DILUIDAS-CONCENTRADAS-SATURADAS-SOBRESATURADAS. Estas soluciones son medidas mediante unidades físicas, como son; % en masa, % en volumen, % en masa-volumen, g/l, mg% y ppm. Igualmente se puede medir por medio de unidades químicas, como molaridad, normalidad y molalidad.
- Si conducen o no la corriente eléctrica: Las soluciones acuosas pueden ser : electrolitos y no electrolitos.
PROCESO:
Es el que sufre una sustancia o soluto a formar una solución con un solvente. Este proceso ocurre en unas ocasiones por rompimiento de las fuerzas de atracción, las cuales mantienen unidas las moléculas del soluto, a causa de esto se produce un aislamiento de las moléculas por el recubrimiento del solvente.Este fenómeno se conoce como solvatación.
En estos videos conoceras mas acerca de los aspectos básicos de soluiones y mezclas.
A continuación te mostraremos unos mapas que te ayudaran a ampliar la información que hemos presentado.
- Principales clases de soluciones
| Solución | Disolvente | Soluto | Ejemplos |
| Gaseosa | Gas | Gas | Aire |
| Liquida | Liquido | Liquido | Alcohol en agua |
| Liquida | Liquido | Gas | O2 en H2O |
| Liquida | Liquido | Sólido | NaCl en H2 |
BIBLIOGRAFÍA:
- Química y ambiebte 1 segunad edición,Autor: Fidel Cárdenas y Carlos Gélvez, Editorial: Mc Graw Hill, Fecha de publicación:1999-1995, Título: El agua y las soluciones , Página 187-205.
- Conceptos básicos de química, Autor: Aln Sherman Sharon J y Leonel Russikoff, Editorial: CeCSA, Página: 50-53.
- Preuniversitario formate es nuestro reto, Fecha de publicación: 2008, Título: VI Soluciones Página136-142.
- Exploremos la química, Autor: Julio Armando Pedrozo P y Rúben Darío Torrenegra G, Editorial:Pearson Educación de Colombia ltda, Fecha de publicación:2000, Título:¿Qué caracteriza a una solución?, Página: 346-355.
- Química, Autor: Timberlake, Editorial:Pearson, Página: 346.
- Química y ambiente 2 tercera edición, Autor: fidel A. Cárdenas S. y Carlos A. Gélvez S., Editorial: Mc Graw Hill, Fecha de publicación: 1999-1995, Página: 200.


esta chingon
ResponderEliminar